پرسش درباره امکان درمان قطعی کبد چرب گرید 4، در واقع پرسشی درباره سرنوشت پیشرفتهترین و شدیدترین مرحله آسیب کبدی است؛ وضعیتی که در ادبیات پزشکی با نام سیروز کبدی شناخته میشود. پاسخ صریح و مبتنی بر شواهد علمی به این سوال، پیچیده است و نیازمند درک عمیقی از ماهیت این بیماری است.
سیروز، به معنای جایگزینی بافت سالم و عملکردی کبد با بافت اسکار (فیبروز) گسترده است که ساختار طبیعی این اندام حیاتی را تخریب کرده و عملکرد آن را به شدت مختل میکند. در این مرحله، آسیب به حدی گسترده است که بازگرداندن کامل کبد به وضعیت اولیه، متأسفانه، امکانپذیر نیست. بنابراین، هنگامی که از درمان صحبت میکنیم، هدف اصلی دیگر «ریشهکن کردن» بیماری نیست، بلکه تمرکز بر یک استراتژی جامع مدیریتی قرار میگیرد.
این استراتژی بر کند کردن روند پیشرفت بیماری، کنترل فعال عوارض تهدیدکننده حیات، و در نهایت، بهبود کیفیت و افزایش طول عمر بیمار استوار است. سیروز ناشی از بیماری کبد چرب غیرالکلی، یک عارضه سیستمیک با ریشههای عمیق متابولیک است که مدیریت موفق آن مستلزم یک برنامه درمانی چندوجهی و پایبندی کامل بیمار به دستورالعملهای پزشکی است.
با وجود اینکه درمان قطعی وجود ندارد، پیشرفتهای علمی امیدهای جدیدی را برای کنترل بیماری و حتی معکوس کردن بخشی از آسیبها در مراحل خاصی از سیروز ایجاد کردهاند. این مسیر درمانی، اگرچه چالشبرانگیز است، اما نشان میدهد که تشخیص سیروز به معنای پایان راه نیست، بلکه آغاز یک دوره جدید از مراقبتهای دقیق و هدفمند برای حفظ سلامت باقیمانده کبد و کل بدن است.
کبد چرب گرید 4 (سیروز کبدی) چیست؟
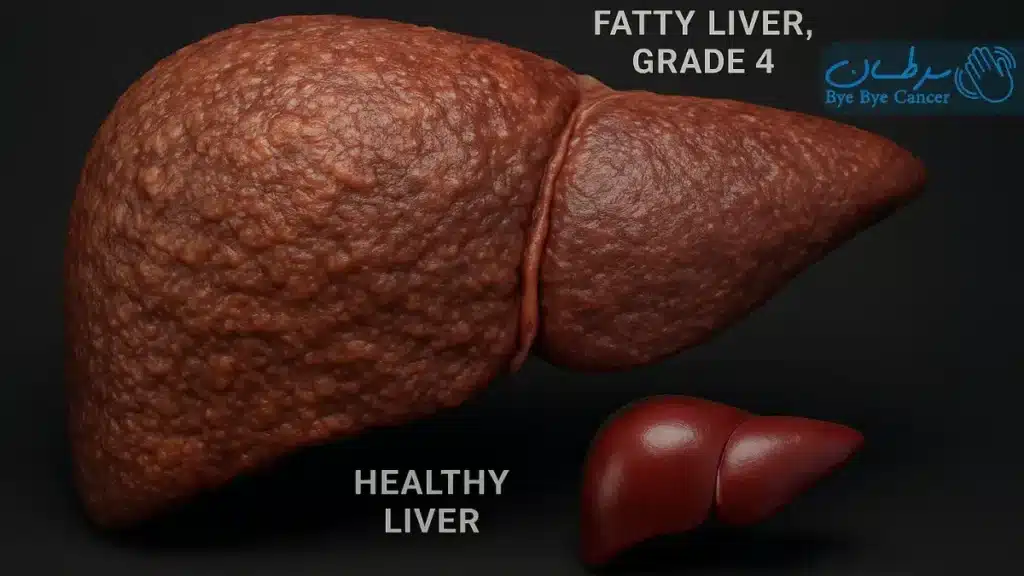
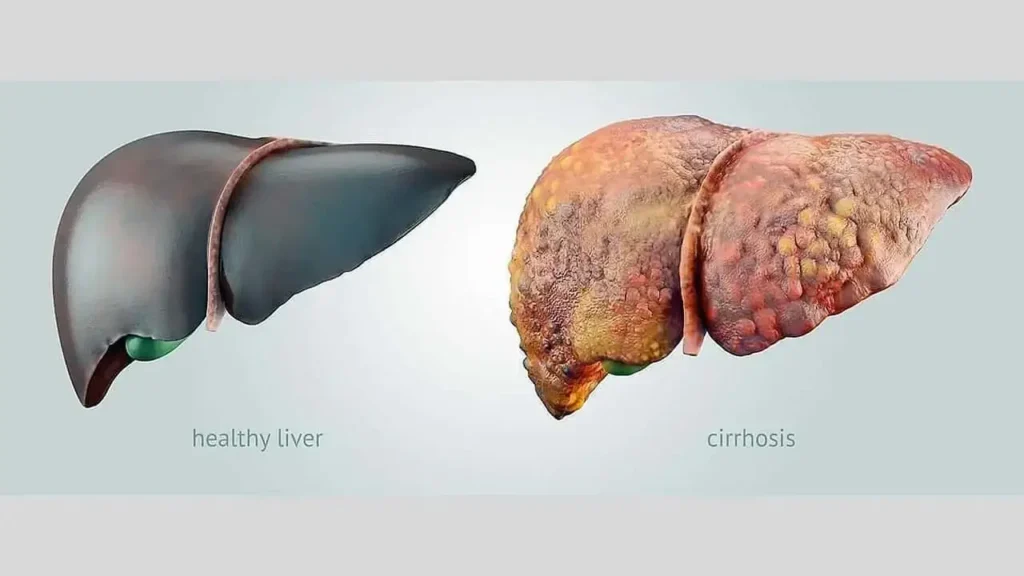
کبد چرب گرید 4، که در سیستمهای استاندارد مرحلهبندی فیبروز با کد F4 مشخص میشود، نقطه پایانی یک مسیر تخریبی طولانی است که از تجمع چربی در کبد آغاز میشود. این وضعیت، نتیجه نهایی یک فرآیند التهابی مزمن است که امروزه با عنوان دقیقتر استئاتوهپاتیت مرتبط با اختلال عملکرد متابولیک (MASH) شناخته میشود؛ اصطلاحی که جایگزین عنوان قدیمیتر استئاتوهپاتیت غیرالکلی (NASH) شده است تا بر ریشه متابولیک بیماری تأکید کند. در مرحله سیروز، بافت اسکار به قدری در کبد گسترش یافته که ساختار لوبولار و عروقی آن را به هم ریخته و تودههایی از سلولهای کبدی بازسازیشده را در خود محبوس میکند.
این دگرگونی ساختاری، کبد را از یک اندام نرم و انعطافپذیر به یک بافت سخت و گرهدار تبدیل میکند. در چنین وضعیتی، کبد تواناییهای حیاتی خود را به تدریج از دست میدهد؛ توانایی پردازش مواد مغذی جذبشده از روده، تولید پروتئینهای حیاتی مانند آلبومین و فاکتورهای انعقادی خون، تولید صفرا برای هضم چربیها و پاکسازی سموم، داروها و مواد زائد از جریان خون، همگی به شدت مختل میشوند.
مفهوم متضاد سیروز، کبد سالم است؛ عضوی با بافت یکنواخت و نرم، بدون هیچگونه اسکار و با عملکردی کامل و بینقص که قادر به انجام صدها وظیفه متابولیک پیچیده است. درک این تفاوت، شدت آسیب در گرید ۴ را به خوبی روشن میسازد.
مراحل پیشرفت بیماری کبد چرب غیرالکلی (MASLD)
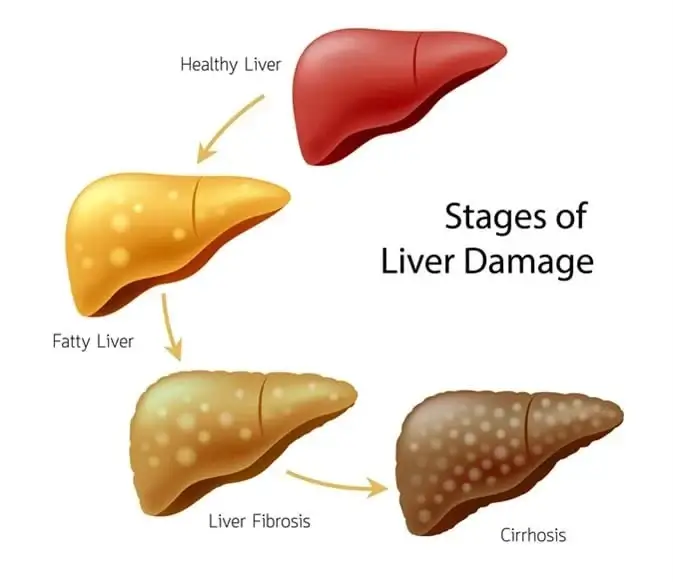
آسیب کبدی ناشی از اختلالات متابولیک، یک شبه رخ نمیدهد، بلکه حاصل یک پیشرفت تدریجی و معمولاً خاموش در طول سالهاست. این مسیر تخریبی عموماً از یک الگوی چهار مرحلهای پیروی میکند که درک آن برای تشخیص زودهنگام و مداخله به موقع حیاتی است.
مرحله اول، استئاتوز یا کبد چرب ساده (گرید ۱) است. در این مرحله، صرفاً تجمع قطرات چربی در سلولهای کبدی (هپاتوسیتها) مشاهده میشود، بدون آنکه التهاب یا آسیب سلولی قابل توجهی وجود داشته باشد. این مرحله اغلب برگشتپذیر است و به عنوان کمخطرترین فاز بیماری شناخته میشود.
اگر عوامل زمینهای کنترل نشوند، بیماری میتواند وارد مرحله دوم، یعنی استئاتوهپاتیت (MASH یا گرید ۲) شود. این مرحله نقطه عطف بیماری است؛ زیرا علاوه بر تجمع چربی، التهاب و آسیب سلولی (بالونینگ هپاتوسیتها) نیز به تصویر بالینی اضافه میشود. MASH مرحله بحرانی و فعال بیماری است و بالاترین ریسک پیشرفت به سمت مراحل شدیدتر را دارد. حدود ۲۰ درصد از افراد مبتلا به کبد چرب ساده در نهایت به MASH مبتلا میشوند.
التهاب مزمن در مرحله MASH، مکانیسمهای ترمیمی کبد را به طور مداوم فعال میکند که این امر به تولید و رسوب پروتئینهای کلاژن و تشکیل بافت اسکار منجر میشود. این فرآیند، مرحله سوم بیماری یعنی فیبروز (گرید ۳) را رقم میزند. در این مرحله، بافت اسکار به تدریج جایگزین بافت سالم میشود و جریان خون در کبد را مختل کرده و عملکرد آن را کاهش میدهد.
نهایت این مسیر، مرحله چهارم یا سیروز (گرید ۴ یا F4) است. در این فاز، فیبروز به قدری گسترده و فراگیر میشود که تمام ساختار طبیعی کبد را تخریب میکند. هر مرحله از این بیماری، در صورت عدم تشخیص و مدیریت صحیح، میتواند به مرحله بعدی پیشرفت کرده و شدت آسیب، از تجمع صرف چربی به التهاب، آسیب سلولی و در نهایت اسکار غیرقابل بازگشت، افزایش مییابد.
تمایز حیاتی سیروز جبرانشده در مقابل جبراننشده
تشخیص سیروز (گرید ۴) تنها یک برچسب تشخیصی نیست، بلکه ارزیابی دقیق وضعیت بالینی بیمار برای تعیین پیشآگهی و انتخاب بهترین راهکار درمانی از اهمیت بالایی برخوردار است. بر این اساس، سیروز به دو فاز بالینی اصلی تقسیم میشود که تفاوت چشمگیری در سرنوشت بیمار ایجاد میکنند.
فاز اول، سیروز جبرانشده (Compensated Cirrhosis) است. در این مرحله، با وجود آسیب ساختاری گسترده و وجود فیبروز F4، کبد هنوز ذخیره عملکردی کافی برای انجام وظایف حیاتی خود را دارد. در نتیجه، بیمار معمولاً بدون علامت یا با علائم غیراختصاصی خفیف مانند خستگی است و هیچیک از عوارض عمده نارسایی کبد مانند آسیت (تجمع مایع در شکم)، یرقان (زردی پوست و چشم)، خونریزی واریسی یا آنسفالوپاتی کبدی (اختلال عملکرد مغز) در او مشاهده نمیشود.
پیشآگهی در این مرحله به طور قابل توجهی بهتر است و مطالعات نشان دادهاند که میانگین بقای بیماران مبتلا به سیروز جبرانشده بیش از ۱۲ سال است.
با این حال، در صورت ادامه یافتن عامل آسیبرسان یا بروز یک استرس فیزیولوژیک جدید (مانند عفونت)، بیماری میتواند وارد فاز دوم، یعنی سیروز جبراننشده (Decompensated Cirrhosis) شود. این مرحله زمانی آغاز میشود که بیمار برای اولین بار حداقل یکی از عوارض بالینی عمده ذکر شده را تجربه کند.
بروز این عوارض نشان میدهد که کبد دیگر قادر به جبران آسیبها نیست و نارسایی بالینی آشکار شده است. ورود به این فاز، یک نقطه عطف بسیار نگرانکننده در سیر بیماری است، زیرا میانگین بقای بیماران به شدت کاهش یافته و به طور متوسط به حدود ۲ سال میرسد.
دادههای آماری نشان میدهد که نرخ پیشرفت از سیروز جبرانشده به جبراننشده، حدود ۳.۵۳ در هر ۱۰۰ نفر-سال است. حضور واریسهای مری در بیماران دارای سیروز جبرانشده، خود یک عامل خطر مهم است که احتمال ورود به فاز جبراننشده را افزایش میدهد.
ابزارهای ارزیابی شدت سیروز: معیار Child-Pugh و MELD
برای ارزیابی عینی شدت نارسایی کبد، پیشبینی بقای بیمار و کمک به تصمیمگیریهای پیچیده درمانی، به ویژه در مورد زمان مناسب برای ارجاع جهت پیوند کبد، پزشکان از سیستمهای نمرهدهی استاندارد و معتبر جهانی استفاده میکنند. دو مورد از مهمترین این ابزارها، معیار Child-Pugh و مدل MELD هستند.
معیار Child-Pugh (CTP) یک سیستم نمرهدهی بالینی است که بر اساس پنج پارامتر کلیدی طراحی شده است: سه پارامتر آزمایشگاهی شامل سطح آلبومین و بیلیروبین در سرم و نسبت نرمالشده بینالمللی (INR) که وضعیت انعقاد خون را نشان میدهد؛ و دو پارامتر بالینی شامل شدت آسیت و درجه آنسفالوپاتی کبدی. به هر یک از این پارامترها بر اساس شدت، نمرهای بین ۱ تا ۳ اختصاص داده میشود.
مجموع نمرات، بیمار را در یکی از سه کلاس A، B یا C قرار میدهد. کلاس A (نمره ۵-۶) نشاندهنده سیروز جبرانشده با بهترین پیشآگهی است؛ بقای یکساله در این گروه تقریباً ۱۰۰٪ و بقای دوساله ۸۵٪ است. کلاس B (نمره ۷-۹) نشاندهنده سیروز با شدت متوسط است که بقای یکساله و دوساله آن به ترتیب حدود ۸۰٪ و ۶۰٪ میباشد. کلاس C (نمره ۱۰-۱۵) نمایانگر سیروز پیشرفته و جبراننشده با پیشآگهی ضعیف است که در آن بقای یکساله به ۴۵٪ و بقای دوساله به ۳۵٪ کاهش مییابد.
مدل بیماری کبدی مرحله نهایی (MELD) ابزار دیگری است که عمدتاً برای ارزیابی شدت بیماری و تعیین اولویت بیماران در لیست انتظار پیوند کبد به کار میرود. این مدل بر خلاف Child-Pugh، کاملاً بر اساس سه پارامتر آزمایشگاهی عینی محاسبه میشود: بیلیروبین توتال، INR و کراتینین سرم (که عملکرد کلیه را نیز منعکس میکند).
این سیستم نمرهای بین ۶ (کمترین شدت) تا ۴۰ (بیشترین شدت) تولید میکند. هرچه نمره MELD بالاتر باشد، خطر مرگ و میر بیمار در کوتاهمدت (مثلاً ۳ ماه آینده) بیشتر بوده و در نتیجه، فوریت نیاز به پیوند کبد افزایش مییابد. این دو سیستم در کنار هم، دید جامعی از وضعیت فعلی و آینده بیمار به تیم درمانی ارائه میدهند.
آیا سیروز F4 قابل درمان است؟ پاسخ بنیادین
پاسخ بنیادین و صادقانه به این سوال که آیا سیروز یا کبد چرب گرید 4 قابل درمان است، یک «نه» قاطع در معنای بازگشت کامل کبد به وضعیت طبیعی و سالم اولیه است. هنگامی که بیماری به مرحله فیبروز F4 میرسد، آسیب وارد شده به سلولهای کبدی و به ویژه تخریب ساختار معماری کبد توسط بافت اسکار، یک فرآیند عمدتاً غیرقابل برگشت است.
بافت اسکار فاقد سلولهای عملکردی کبد است و نمیتواند وظایف متابولیک پیچیده را انجام دهد. بنابراین، هدفگذاری درمانی در این مرحله به طور کامل تغییر میکند و از تلاش برای «درمان قطعی» به یک استراتژی واقعبینانهتر یعنی «کند کردن پیشرفت بیماری، مدیریت فعال عوارض و بهبود کیفیت زندگی» منتقل میشود. در حقیقت، مفهوم متضاد «درمانناپذیری قطعی»، «قابلیت مدیریت و کنترل بیماری» است.
این بدان معناست که اگرچه نمیتوان ساعت را به عقب برگرداند، اما میتوان از حرکت سریعتر عقربههای آن جلوگیری کرد. حتی در صورت مدیریت موفق بیماری، باید به این واقعیت توجه داشت که خطر ابتلا به سرطان کبد در بیمارانی که سابقه سیروز داشتهاند، همچنان به عنوان یک تهدید جدی باقی میماند و نیازمند نظارت دائمی است.
شواهد علمی امیدبخش: قابلیت بازگشت فیبروز
با وجود ماهیت عمدتاً غیرقابل برگشت سیروز، دنیای علم پزشکی در سالهای اخیر شاهد یافتههای هیجانانگیزی بوده که یک نقطه عطف حیاتی در درک ما از پویایی بیماریهای کبدی ایجاد کرده است: قابلیت بازگشت فیبروز پیشرفته (Regression of Fibrosis). تحقیقات متعدد نشان دادهاند که حتی در برخی موارد سیروز جبرانشده، بهبود و کاهش قابل توجه بافت اسکار امکانپذیر است. این دیدگاه بر این واقعیت استوار است که MASH/MASLD در درجه اول یک بیماری متابولیک است. بنابراین، کلید اصلی در تمرکز بر درمان علت زمینهای نهفته است.
متخصصان برجستهای مانند دکتر نورمن ساسمن تأکید میکنند که بیمارانی که موفق به بهبود مشخصات متابولیک خود میشوند (از طریق کاهش وزن، کنترل دیابت و فشار خون)، میتوانند شاهد برطرف شدن کامل التهاب کبدی یا MASH باشند. نکته شگفتانگیز این است که تقریباً نیمی از این افراد، بهبود فیبروز را تا حدی تجربه میکنند که عملکرد کبدشان به سطح تقریباً طبیعی بازمیگردد.
مکانیسم این پدیده به این صورت است که با کنترل عوامل متابولیک، التهاب در کبد فروکش میکند. کاهش التهاب به نوبه خود، فرآیند تولید بافت اسکار جدید را متوقف کرده و به بدن این فرصت را میدهد تا مکانیسمهای طبیعی خود برای تجزیه کلاژن را فعال کند و بافت اسکار موجود را با سرعتی بیشتر از سرعت تشکیل آن، حل نماید.
این شواهد علمی امیدبخش نشان میدهد که کبد، حتی در مراحل پیشرفته بیماری، از ظرفیت قابل توجهی برای ترمیم خود برخوردار است، مشروط بر اینکه عامل آسیبرسان اولیه به طور مؤثر حذف گردد.
موانع کلیدی در مدیریت MASH پیشرفته: شکاف آموزشی و تشخیص دیرهنگام
علیرغم پیشرفتهای چشمگیر در درک بیماری و وجود دستورالعملهای بالینی جامع از سوی نهادهای معتبری مانند انجمن آمریکایی مطالعه بیماریهای کبد (AASLD) و انجمن اروپایی مطالعه کبد (EASL)، موانع مهمی در مسیر ارائه مراقبت بهینه برای بیماران مبتلا به MASH پیشرفته و سیروز وجود دارد.
یکی از بزرگترین و شاید اصلیترین این چالشها، شکاف آموزشی و عدم آگاهی کافی است. این ناآگاهی تنها به بیماران محدود نمیشود و گاهی در میان پزشکان مراقبتهای اولیه یا حتی متخصصان سایر رشتهها نیز دیده میشود.
بسیاری از بیماران تا زمانی که با نتایج تستهای غیرتهاجمی مانند فیبرواسکن یا بیوپسی کبد مبنی بر وجود فیبروز پیشرفته یا سیروز مواجه نشوند، از شدت بیماری خود بیاطلاع هستند. دکتر مازن نورالدین، یکی از متخصصان این حوزه، اشاره میکند که غافلگیری بیماران در هنگام شنیدن تشخیص، یک تجربه رایج است. این عدم آگاهی باعث میشود که بیماری در سکوت به مراحل پایانی خود، مانند نارسایی کبدی جبراننشده یا سرطان کبد، پیشرفت کند.
از این رو، متخصصان بر این باورند که فاز اول و حیاتی درمان، آموزش است؛ آموزش به بیماران در معرض خطر، به ویژه افراد چاق، مبتلایان به دیابت نوع دو و فشار خون بالا، در مورد ریسکهای کبد چرب و اهمیت غربالگری. همانطور که برخی صاحبنظران تأکید میکنند، وظیفه بزرگ جامعه پزشکی در این زمینه «آموزش، آموزش و باز هم آموزش» است تا بتوان با تشخیص به موقع، از عواقب جبرانناپذیر بیماری جلوگیری کرد.
استراتژیهای خط اول درمان اصلاح سبک زندگی و رژیم غذایی است
از آنجا که سیروز در این زمینه، محصول نهایی یک اختلال عملکرد متابولیک طولانیمدت است، منطقی است که بنیاد و اساس مدیریت درمانی آن بر اصلاح همین اختلالات متمرکز باشد. تغییرات پایدار در سبک زندگی و کنترل شدید عوامل خطر متابولیک، حتی در شدیدترین مراحل بیماری نیز به عنوان خط مقدم و شالوده اصلی درمان در نظر گرفته میشود. این استراتژی، اگرچه ساده به نظر میرسد، اما قدرتمندترین ابزار موجود برای متوقف کردن پیشرفت بیماری و بهبود عملکرد باقیمانده کبد است.
مفهوم متضاد این رویکرد، یعنی ادامه دادن به عادات ناسالم مانند رژیم غذایی پرچرب و پرشکر و عدم تحرک، به مثابه ریختن بنزین بر آتش التهاب کبد است و روند تخریب را به شدت تسریع میکند. بنابراین، هرگونه مداخله دارویی یا بالینی پیشرفته، بدون پایبندی بیمار به اصلاح سبک زندگی، اثربخشی محدودی خواهد داشت. این استراتژی در تمام مراحل، از گرید ۱ تا ۴، مؤثر است و هیچگاه برای شروع آن دیر نیست.
نقش حیاتی کاهش وزن تدریجی و علمی
در میان تمام مداخلات مرتبط با سبک زندگی، کاهش وزن به عنوان مؤثرترین درمان برای MASLD و MASH شناخته میشود. کاهش توده چربی بدن به طور مستقیم شرایط زمینهای را که به تجمع چربی و ایجاد التهاب در کبد کمک میکنند، تعدیل مینماید. تأثیر کاهش وزن بر سلامت کبد، به درصد کاهش وزن بستگی دارد. شواهد علمی معتبر نشان میدهد که کاهش تنها ۳ تا ۵ درصد از کل وزن بدن میتواند منجر به کاهش قابل توجه چربی انباشته شده در کبد (استئاتوز) شود.
با این حال، برای دستیابی به هدف مهمتر، یعنی کاهش التهاب (MASH) و توقف آسیب سلولی، کاهش وزن بیشتری مورد نیاز است؛ به طور مشخص، کاهش حداقل ۷ درصدی وزن بدن.
بر این اساس، اهداف بالینی که توسط پزشکان توصیه میشود، معمولاً کاهش تدریجی ۷ تا ۱۰ درصد از وزن بدن طی یک دوره زمانی منطقی، مانند یک سال، است. نکته بسیار مهم این است که این کاهش وزن باید به صورت تدریجی و علمی صورت گیرد. کاهش وزن سریع از طریق روزهداریهای شدید، رژیمهای بسیار کمکالری یا سایر روشهای غیرعلمی، به شدت منع میشود؛ زیرا میتواند به طور متناقضی با ایجاد استرس متابولیک، وضعیت کبد چرب را بدتر کند.
روشهای بهینه کاهش وزن شامل کاهش کنترلشده کالری دریافتی روزانه، مدیریت دقیق حجم وعدههای غذایی و مهمتر از همه، افزایش فعالیت بدنی منظم و پایدار است.
رژیمهای غذایی توصیه شده و ملاحظات تغذیهای در سیروز
پیروی از یک الگوی غذایی متعادل و سالم، جزء جداییناپذیر مدیریت کبد چرب گرید 4 است. در میان الگوهای مختلف، رژیم مدیترانهای به دلیل پشتوانه علمی قوی و تمرکز بر غذاهای کامل و غنی از مواد مغذی، اغلب توسط متخصصان توصیه میشود. این رژیم که در واقع یک روش پایدار برای غذا خوردن است و نه یک رژیم موقت، بر مصرف بالای سبزیجات، میوهها، غلات کامل، حبوبات، مغزها و دانهها تأکید دارد. منبع اصلی چربی در این رژیم، چربیهای تکغیراشباع سالم مانند روغن زیتون است.
بیماران مبتلا به سیروز کبدی، علاوه بر اصول کلی رژیم سالم، باید به ملاحظات تغذیهای خاصی نیز توجه کنند. آنها باید به شدت از مصرف شکر افزوده، نوشیدنیهای شیرین شده با شکر، و مصرف بیش از حد گوشت قرمز و محصولات لبنی پرچرب پرهیز کنند، زیرا این مواد غذایی میتوانند التهاب را تشدید کرده و بار متابولیک بر کبد را افزایش دهند. در مقابل، تأمین پروتئین با کیفیت از منابعی مانند گوشت بدون چربی، مرغ بدون پوست و ماهی، برای جلوگیری از تحلیل عضلانی که در بیماران سیروتیک شایع است، اهمیت ویژهای دارد.
همچنین، دریافت کافی ویتامینها و مواد معدنی از طریق مصرف فراوان سبزیجات و میوهها برای این بیماران ضروری است. در کنار این موارد، مطالعات نشان دادهاند که نوشیدن منظم قهوه به دلیل دارا بودن ترکیبات آنتیاکسیدانی و ضدالتهابی، میتواند در کاهش تجمع چربی و کند کردن روند فیبروز در کبد مؤثر باشد.
مدیریت بالینی عوارض سیروز جبراننشده
هنگامی که سیروز از فاز جبرانشده عبور کرده و وارد مرحله جبراننشده میشود، اولویتهای درمانی تغییر کرده و هدف اصلی بر کنترل فعال عوارض تهدیدکننده حیات متمرکز میشود. این عوارض عمدتاً ناشی از یک پدیده مرکزی به نام پرفشاری پورتال (Portal Hypertension) هستند. پرفشاری پورتال به معنای افزایش غیرطبیعی فشار در ورید پورت (ورید باب) است؛ ورید بزرگی که خون را از دستگاه گوارش به کبد منتقل میکند.
بافت اسکار در کبد سیروتیک، مقاومت در برابر جریان خون را افزایش داده و باعث بالا رفتن فشار در این سیستم میشود. این افزایش فشار، منجر به بروز عوارض زنجیرهای خطرناکی مانند آسیت، آنسفالوپاتی کبدی و خونریزی واریسی میگردد که هر کدام نیازمند استراتژیهای درمانی خاص و فوری هستند. مدیریت موفق این عوارض میتواند به طور قابل توجهی بقا و کیفیت زندگی بیماران را در این مرحله پیشرفته بهبود بخشد.
مدیریت آسیت و پیشگیری از عفونت
آسیت، به معنای تجمع غیرطبیعی مایع در حفره شکمی، یکی از شایعترین و اولین عوارض سیروز جبراننشده است. این وضعیت به دلیل ترکیبی از پرفشاری پورتال و کاهش توانایی کبد در تولید پروتئین آلبومین (که به نگه داشتن مایع در عروق کمک میکند) رخ میدهد. درمان خط اول برای آسیت متوسط، استفاده از داروهای دیورتیک (ادرارآور) است. معمولاً درمان با اسپیرونولاکتون، یک دیورتیک نگهدارنده پتاسیم، آغاز میشود.
در صورتی که آسیت به درمان دارویی پاسخ ندهد (آسیت مقاوم)، از روشهای تهاجمیتر مانند TIPS (شانت پورتوسیستمیک داخل کبدی از طریق ورید ژوگولار) استفاده میشود. در این روش، یک استنت بین ورید پورت و یکی از وریدهای کبدی قرار داده میشود تا با ایجاد یک مسیر میانبر، فشار پورتال به طور مستقیم کاهش یابد.
یک عارضه بسیار خطرناک و بالقوه کشنده مرتبط با آسیت، پریتونیت باکتریایی خودبخودی (SBP) است. این وضعیت به معنای بروز عفونت در مایع آسیت، بدون وجود یک منبع عفونی مشخص در شکم است. برای بیمارانی که یک دوره SBP را تجربه کردهاند، یا بیمارانی که به دلیل پروتئین پایین در مایع آسیت در معرض خطر بالا قرار دارند، پیشگیری با آنتیبیوتیکها (مانند نورفلوکساسین) برای جلوگیری از وقوع یا عود این عفونت مرگبار، یک استاندارد مراقبتی ضروری است.
مدیریت آنسفالوپاتی کبدی (HE)
آنسفالوپاتی کبدی (HE) یا اختلال عملکرد مغزی، یک عارضه عصبی-روانی جدی است که به دلیل ناتوانی کبد بیمار در پاکسازی مواد سمی از جریان خون رخ میدهد. مهمترین این سموم، آمونیاک است که عمدتاً توسط باکتریهای روده تولید میشود. تجمع آمونیاک در خون و عبور آن از سد خونی-مغزی، عملکرد طبیعی سلولهای مغزی را مختل کرده و منجر به علائمی از گیجی خفیف و تغییرات خلقی تا خوابآلودگی شدید، اختلال در تکلم و حتی کما میشود.
اولین گام در مدیریت یک دوره حاد HE، شناسایی و حذف عامل زمینهای تحریککننده است که میتواند مواردی چون عفونت، خونریزی گوارشی، مصرف برخی داروها یا کمآبی بدن باشد. درمان استاندارد و خط اول برای کنترل و پیشگیری از HE، استفاده از لاکتولوز است. لاکتولوز یک قند غیرقابل جذب است که در روده بزرگ توسط باکتریها تخمیر میشود. این فرآیند با کاهش pH روده، تبدیل آمونیاک سمی به فرم غیرقابل جذب آمونیوم را تسهیل کرده و همچنین با ایجاد اثر اسموتیک، به دفع سریعتر سموم از طریق مدفوع کمک میکند.
داروی خط دوم، ریفاکسیمین، یک آنتیبیوتیک با جذب سیستمیک بسیار پایین است که با کاهش جمعیت باکتریهای تولیدکننده آمونیاک در روده، به کنترل HE، به ویژه در پیشگیری از عود آن، کمک شایانی میکند.
پیشگیری و مدیریت خونریزی واریسی
خونریزی واریسی یکی از مرگبارترین عوارض سیروز جبراننشده است. پرفشاری پورتال باعث میشود خون به دنبال مسیرهای جایگزین برای بازگشت به قلب بگردد. این امر منجر به گشاد شدن و تورم وریدهای دیواره مری و معده و ایجاد رگهای برجستهای به نام واریس میشود. این واریسها دیواره نازکی دارند و به دلیل فشار بالای درونشان، مستعد پارگی و خونریزیهای حجیم و ناگهانی هستند.
استراتژی اصلی در این زمینه، پیشگیری از اولین خونریزی (پیشگیری اولیه) است. درمان دارویی خط اول، استفاده از بتابلاکرهای غیرانتخابی (NSBBs) مانند پروپرانولول، نادولول و به ویژه کارودیلول است. این داروها با کاهش برونده قلبی و انقباض عروق احشایی، فشار پورتال را کاهش داده و خطر خونریزی را به طور مؤثری کم میکنند.
یک روش جایگزین یا مکمل، لیگاسیون واریسی آندوسکوپی (EVL) است که طی آن، پزشک با استفاده از آندوسکوپ، باندهای پلاستیکی کوچکی را دور واریسهای بزرگ قرار میدهد تا جریان خون در آنها را مسدود کرده و از پارگی آنها جلوگیری کند.
شواهد نشان دادهاند که NSBBs به اندازه EVL در پیشگیری از اولین خونریزی مؤثر هستند و مزیت آنها، تأثیر سیستمیک در کاهش کلی فشار پورتال و پیشگیری از سایر عوارض مانند آسیت است. برای بیمارانی که یک دوره خونریزی را تجربه کردهاند (پیشگیری ثانویه)، مؤثرترین روش برای جلوگیری از خونریزی مجدد، درمان ترکیبی با NSBB و EVL است.
داروهای پیشرفته و افقهای درمانی جدید MASH
تا همین اواخر، جعبه ابزار دارویی پزشکان برای مقابله مستقیم با فرآیندهای التهاب و فیبروز در MASH خالی بود. اما چشمانداز درمانی این بیماری در سال ۲۰۲۴ با یک تحول بزرگ روبرو شد. تأیید اولین داروی هدفمند، امیدهای جدیدی را برای بیماران ایجاد کرده است. با این حال، باید تأکید کرد که اثربخشی این داروهای جدید عمدتاً در مراحل فیبروز متوسط تا پیشرفته (F2 و F3) به اثبات رسیده و کاربرد آنها در مرحله سیروز (F4) هنوز تحت بررسیهای دقیق بالینی قرار دارد.
در حال حاضر، هیچ فارماکوتراپی هدفمندی به طور رسمی برای درمان بیماران مبتلا به سیروز مرتبط با MASH توسط دستورالعملهای پزشکی توصیه نشده است و مدیریت این بیماران همچنان بر کنترل بیماریهای همراه متابولیک و مدیریت عوارض سیروز متمرکز است. چالش اصلی در این زمینه، اطمینان از ایمنی داروها در جمعیت آسیبپذیر سیروتیک است که عملکرد متابولیک کبد آنها به شدت کاهش یافته است.
رزمتیروم (Resmetirom – Rezdiffra) اولین درمان هدفمند
در مارس ۲۰۲۴، سازمان غذا و داروی آمریکا (FDA) با تأیید شتابیافته رزمتیروم (با نام تجاری Rezdiffra)، فصل جدیدی را در درمان MASH گشود. این دارو، اولین و تنها درمان مورد تأیید برای MASH در بزرگسالان است که اندیکاسیون دقیق آن برای بیماران مبتلا به فیبروز متوسط تا پیشرفته (مراحل F2 و F3) صادر شده است. بنابراین، کاربرد اولیه آن در بیماران غیرسیروتیک با فیبروز قابل توجه است.
مکانیسم عمل رزمتیروم، هدف قرار دادن گیرنده بتا هورمون تیروئید کبدی (THR-β) است. این دارو یک آگونیست انتخابی این گیرنده است که به طور عمده در کبد فعال شده و نقش کلیدی در تنظیم متابولیسم چربیها و کلسترول ایفا میکند. نتایج کارآزمایی بالینی فاز ۳ (MAESTRO-NASH) که منجر به تأیید این دارو شد، بسیار امیدوارکننده بود.
این مطالعه نشان داد که رزمتیروم نه تنها باعث رفع التهاب (رزولوشن MASH) بدون بدتر شدن فیبروز میشود، بلکه در درصد قابل توجهی از بیماران منجر به بهبود و کاهش درجه فیبروز نیز میگردد. این اثر دوگانه (ضدالتهاب و ضدفیبروز) آن را به یک گزینه درمانی بسیار جذاب تبدیل کرده است. خبر مهم برای بیماران سیروتیک این است که شرکت سازنده در حال انجام یک کارآزمایی بالینی فاز ۳ دیگر برای ارزیابی اثربخشی و ایمنی رزمتیروم در جمعیت مبتلا به سیروز جبرانشده (F4c) است که نتایج آن میتواند چشمانداز درمان این گروه از بیماران را به کلی دگرگون سازد.
داروهای امیدبخش در مراحل پیشرفته بالینی (سماگلوتاید و لانیفیبرانور)
در کنار رزمتیروم، چندین داروی دیگر نیز در مراحل پیشرفته کارآزماییهای بالینی، نتایج بسیار مثبتی را در درمان MASH با فیبروز F2-F3 نشان دادهاند و امید به توسعه گزینههای درمانی متنوعتر را افزایش دادهاند.
یکی از برجستهترین این داروها، سماگلوتاید (Semaglutide) است. این دارو که یک آگونیست پپتید شبه گلوکاگون-۱ (GLP-1) است، در اصل برای درمان دیابت نوع ۲ و چاقی توسعه یافته و به دلیل تأثیر چشمگیر در کاهش وزن، محبوبیت زیادی کسب کرده است. نتایج بافتشناسی از کارآزماییهای بالینی نشان داده که سماگلوتاید در بیماران مبتلا به MASH و فیبروز F2/F3، به طور قابل توجهی در رفع استئاتوهپاتیت بدون بدتر شدن فیبروز، مؤثرتر از دارونما بوده است.
انتظار میرود نتایج نهایی مطالعات طولانیمدت مشخص کند که آیا این بهبودهای بافتشناسی به کاهش رویدادهای بالینی مهم مانند نیاز به پیوند کبد و مرگ و میر منجر خواهد شد یا خیر.
داروی امیدبخش دیگر، لانیفیبرانور (Lanifibranor) است. این دارو یک آگونیست پان-PPAR است، به این معنی که هر سه ایزوفرم گیرندههای PPAR (آلفا، دلتا و گاما) را فعال میکند. این گیرندهها نقش کلیدی در تنظیم متابولیسم چربی، گلوکز و فرآیندهای التهابی دارند. مطالعات نشان دادهاند که لانیفیبرانور با بهبود حساسیت به انسولین و کاهش عوامل خطر قلبی-عروقی، سلامت کاردیومتابولیک کلی بیماران MASH را بهبود میبخشد. این داروهای جدید با مکانیسمهای عمل متفاوت، پتانسیل استفاده به صورت ترکیبی برای هدف قرار دادن همزمان جنبههای مختلف بیماری را در آینده نوید میدهند.
مراحل پایانی، پیوند کبد و پیشگیری از سرطان
سیروز گرید 4 یک بیماری پیشرونده است که در صورت عدم کنترل مؤثر، میتواند به دو پیامد نهایی بسیار جدی منجر شود: نارسایی کامل کبد یا سرطان کبد. بنابراین، استراتژی مدیریتی در این مرحله پیشرفته، علاوه بر کنترل عوارض، بر پیشگیری و تشخیص زودهنگام سرطان و در نهایت، ارزیابی بیمار برای پیوند کبد به عنوان تنها گزینه درمانی نجاتبخش، متمرکز میشود. با توجه به همهگیری جهانی چاقی و دیابت، MASH به سرعت در حال تبدیل شدن به یکی از دلایل اصلی بروز سرطان کبد و نیاز به پیوند کبد در سراسر جهان است، که این امر اهمیت غربالگری و مدیریت صحیح این بیماران را دوچندان میکند.
ریسک بالای کارسینوم هپاتوسلولار (HCC)
کارسینوم هپاتوسلولار (HCC)، شایعترین نوع سرطان اولیه کبد و یکی از علل اصلی مرگ و میر مرتبط با سرطان در سطح جهان است. سیروز کبدی ناشی از هر علتی، از جمله MASH، به عنوان یک حالت پیشسرطانی در نظر گرفته میشود و مهمترین عامل خطر برای ایجاد HCC است. التهاب مزمن و فرآیندهای بازسازی مداوم در کبد سیروتیک، محیطی را فراهم میکند که احتمال بروز جهشهای ژنتیکی و رشد کنترلنشده سلولها را افزایش میدهد.
یک نکته بالینی بسیار مهم که متخصصان بر آن تأکید دارند، ریسک ماندگار سرطان است. حتی اگر با مداخلات درمانی مؤثر، التهاب کنترل شده و فیبروز تا حدی بهبود یابد، بیمارانی که یک بار تشخیص سیروز برای آنها قطعی شده است، همچنان در معرض خطر بالای ابتلا به HCC باقی میمانند. به همین دلیل، ایجاد و پایبندی به یک برنامه نظارتی منظم (Surveillance Program) برای این بیماران امری مطلقاً ضروری است.
این برنامه معمولاً شامل انجام سونوگرافی شکم هر شش ماه یک بار (گاهی همراه با اندازهگیری سطح آلفا-فتوپروتئین خون) است تا هرگونه توده مشکوک در مراحل اولیه و قابل درمان شناسایی شود. در صورتی که نیاز به مشاوره و راهنمایی بیشتر در این زمینه دارید، مراجعه به یک دکتر متخصص داخلی فوق تخصص گوارش و کبد میتواند بهترین مسیر تشخیصی و نظارتی را برای شما مشخص کند.
پیوند کبد: راه نجات نهایی
برای بیمارانی که بیماری آنها به سمت نارسایی کبدی مرحله نهایی (End-Stage Liver Disease) پیشرفت میکند و دچار سیروز جبراننشده با عوارض غیرقابل کنترل میشوند، پیوند کبد تنها گزینه درمانی نجاتبخش و قطعی محسوب میشود. زمانی که کبد دیگر قادر به انجام وظایف حیاتی خود نیست و کیفیت زندگی بیمار به شدت افت کرده و بقای او در معرض خطر جدی قرار دارد، جایگزینی کبد بیمار با یک کبد سالم اهدایی، تنها راه برای ادامه حیات است.
اندیکاسیونهای اصلی برای ارجاع بیمار جهت پیوند کبد شامل مواردی چون آسیت مقاوم به درمان دارویی، خونریزیهای واریسی عودکننده با وجود درمانهای استاندارد، آنسفالوپاتی کبدی شدید و غیرقابل کنترل، و نارسایی سنتتیک شدید کبد (که با INR بالا و آلبومین پایین مشخص میشود) است.
همچنین، بیماران مبتلا به HCC که تومور آنها در مراحل اولیه و در محدوده معیارهای خاصی (مانند معیارهای میلان) قرار دارد نیز کاندید پیوند کبد میشوند. اولویتبندی بیماران در لیست طولانی انتظار برای پیوند، بر اساس شدت بیماری و احتمال مرگ و میر در کوتاهمدت انجام میشود که این ارزیابی عمدتاً با استفاده از سیستم نمرهدهی MELD صورت میگیرد. پیوند کبد یک جراحی بزرگ و پیچیده است که نیازمند یک تیم پزشکی چندتخصصی و مراقبتهای مادامالعمر پس از عمل، از جمله مصرف داروهای سرکوبکننده سیستم ایمنی برای جلوگیری از رد پیوند، میباشد.